|
|
9月4日,我国数以万计的晚期结直肠癌患者终于迎来了一款疗效确切的新型抗血管生成靶向药物——呋喹替尼(Fruquintinib)。
从李进教授与秦叔逵教授领衔发表在JAMA上的III期临床研究结果来看[1],呋喹替尼将患者的中位生存时间延长了41%,疾病中位无进展生存期延长106%,这是目前改善晚期结直肠癌患者三线治疗生存期最长的数据之一。
饿死癌细胞
“兵马未动粮草先行。”
肿瘤在生长和扩张的过程中也深谙这个道理。
早在1907年,肿瘤学家E. Goldmann就在《柳叶刀》发表论文[1],描述了肿瘤血管的特征:它们四处扩张,生长速度快,排列不规则。这是科学家首次注意到肿瘤里的血管。
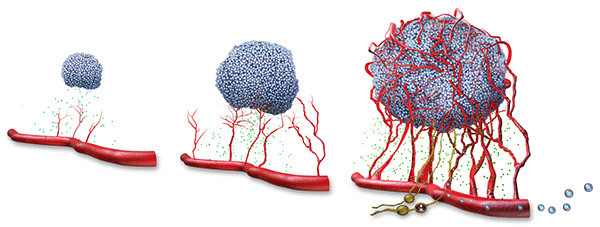
不过当时科学家并不清楚,肿瘤血管的这种行为与肿瘤的生长是否有关。即使到了1927年,肿瘤学家Lewis WH认为,血管的生成不是肿瘤生长的决定性因素,只不过是肿瘤影响了血管的生长[2]。
在人类对癌症的认知史上,Ide等人在1939年首次指出,肿瘤能够释放特定的生长因子,刺激血管生长[3]。1945年,Algire和Chalkley第一次意识到,肿瘤可以影响宿主毛细血管的生长方向[4]。他们认为,肿瘤的生长与内在的血管网络的发展密切相关。
具有里程碑意义的那篇文章发表于1971年。哈佛医学院的教授Judah Folkman在《新英格兰医学杂志》上提出全新的理论,他认为肿瘤生长依赖于血管生成,是肿瘤“唤醒”了血管内皮细胞,并让它们加速分裂,促进肿瘤以每天1毫米的速度生长[5]。
更具有划时代意义的是,他在文章中还创新性地提出了“肿瘤抗血管生成”这一术语。此后,Folkman的这篇文章开启了当今生物医学研究的新纪元,改写了癌症治疗的历史。截止目前,他的这篇论文被引用高达1.3万余次,是肿瘤领域引用频次最高的论文之一。
 Judah Folkman(1933-2008)
Judah Folkman(1933-2008)
20世纪80到90年代,科学家们先后证明肿瘤细胞分泌VEGF,并由此激活VEGF/VEGFR这条促进血管生成的重要信号通路。
现在我们已经知道,VEGF/VEGFR通过刺激内皮细胞增殖,迁移和增强新血管形成来介导血管生成[6]。癌基因的激活[7]或抑癌基因的失活[7],以及肿瘤微环境的缺氧和葡萄糖水平的变化[9],都会刺激肿瘤细胞分泌VEGF。当VEGF与血管内皮细胞上的受体VEGFR结合之后,血管生成就发动了。
大量的研究表明,肿瘤细胞表达与分泌VEGF的水平,与肺癌[10]、胃癌[11]、结肠癌[12]等癌症的预后密切相关。
21世纪初期,针对VEGF/VEGFR的“抗血管生成”的疗法崭露头角:阻断VEGF和VEGFR的结合或直接抑制VEGFR受体的激酶活性,从而阻断VEGF/VEGFR通路的激活。常用药物有两种,抗体药物和小分子抑制剂; 前者阻断VEGF和VEGFR的结合,而后者是VEGFR受体的激酶活性抑制剂。
2004年,贝伐单抗(Bevacizumab)成为首个获得FDA批准的抗血管生成抑制剂,也是目前最成功的抗血管生成单抗类药物。
尽管如此,贝伐单抗在临床应用中也有一些局限性,例如,它不是一款全人源的抗体药物,有一定的免疫原性;它需要通过静脉给药,患者的依从性受限;和其他抗体药物一样,价格也在一定程度上阻碍了它在临床上的可及性。
研发可以口服的小分子药物,成为弥补抗体类药物不足的方法之一。
我们会看到,继贝伐单抗后,一些靶向VEGFR这个靶点的小分子TKI,如舒尼替尼、索拉非尼、瑞格非尼和帕唑帕尼应运而生。
“小分子药物有口服方便的优点,但目前已上市的此类VEGFR小分子抑制剂,多在抑制VEGFR的同时,因选择性欠佳而对其他无关的靶点也有一定的抑制作用, 因此带来的脱靶毒性对药物的耐受性和安全性均有影响。”在礼来中国首席医学官迟海东博士看来,“此类药物患者的依从性和耐受性,长期足量给药的情况仍不能让人满意的。因此继续研发新型的选择性高,结合力强的小分子VEGFR抑制剂有很强的临床需求。”
用质量说话
2005年,苏慰国博士加入和记黄埔医药。彼时,中国原研药的创新领域几乎一片空白。为中国的患者开发质优价廉的原研药,成为众多制药人的目标。
 苏慰国博士(现任和记黄埔医药执行副总裁兼首席科学官)
苏慰国博士(现任和记黄埔医药执行副总裁兼首席科学官)
苏慰国博士带领的团队选择了已经研究的非常成熟的VEGF/VEGFR通路,并综合研发成本以及国内的研发状况,大胆认为:靶向VEGF/VEGFR通路的小分子抑制剂还大有可为。
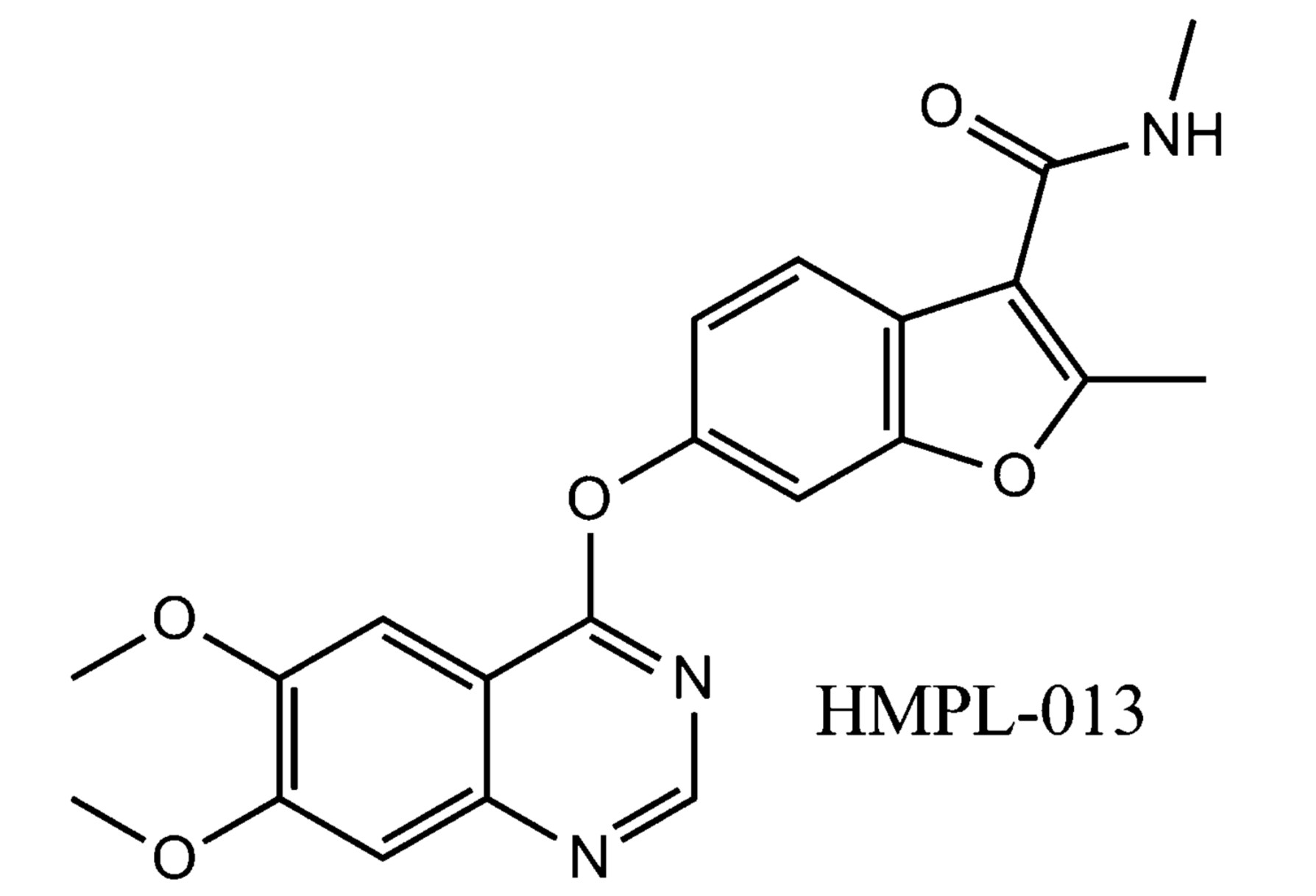
在分析了VEGFR蛋白的分子结构以及激酶活性之后,苏慰国博士的科研团队从中选择了若干他们当时认为有前景的结合位点,进而展开一系列研究、设计、合成,并筛选能够与之结合的小分子化合物。在筛选的过程中,一个编号为HMPL-013的小分子引起了研究人员的注意,它对VEGFR蛋白表现出了出人意料的特异性高亲和力。
这个小分子就是后来为人熟知的呋喹替尼。
在多达253个激酶的检测中,研究人员确定呋喹替尼对VEGFR家族的VEGFR1、2、3的激酶活性抑制率IC50分别为33 nmol/L、35 nmol/L和0.5 nmol/L。即使把呋喹替尼的浓度提高,它对其他激酶的活性仍没有表现出显著的抑制[13]。除了生化实验,细胞实验结果也再次证实呋喹替尼对VEGFR激酶活性的抑制是高度选择性的。
更让研究人员感到振奋的是,呋喹替尼在结肠腺癌(HT-29)、非小细胞肺癌(NSCLC; NCI-H460)、肾透明细胞癌(Caki-1)和胃癌(BGC823)的小鼠异种移植模型上,表现出明显的抗血管生成作用和抗肿瘤活性[13]。而且,在I期临床试验中,研究人员也观察到了呋喹替尼在多种实体瘤中的抗肿瘤活性[14]。
同时,研究人员还从I期临床研究中确定了呋喹替尼的安全用药方案:每日一次性口服4mg,或者前三周每日一次性口服5mg,然后停一周[14]。
至此,呋喹替尼的安全的用药剂量已经敲定。接下来就需要开展验证其有效性的II期临床研究了。
“在启动第一个适应症的临床研究时,我们首先要做的是控制风险,在研究了大量抗血管生成的科学和临床研究数据之后,我们决定把肠癌作为呋喹替尼的首个适应症。”苏慰国博士坦率地说,“而且有研究表明,抗血管生成药物在肠癌的早期临床研究中出现的疗效,对大型III期临床研究有很好的预测作用。”

就在这个时期,跨国制药企业礼来参与到了呋喹替尼的研发中。
实际上,礼来与和记黄埔医药的合作是从2007年开始的,真正参与到呋喹替尼的临床研究是2013年签订的合作协议。
礼来中国首席医学官迟海东博士是当年参与评价呋喹替尼的尽责审核小组成员之一,当时,和记黄埔医药刚刚完成了呋喹替尼的 I 期研究。 其临床前数据显示出了高亲和力和和高选择性的特点,I 期临床研究的数据也显示出了单药抗肿瘤活性。
迟海东博士告诉我们,审核小组对呋喹替尼的早期数据进行了详尽的评价,为了明确其单药抗肿瘤活性,礼来还邀请了第三方影像学专家对患者肿瘤评估的CT、磁共振的结果进行来了独立验证,反复确认了结果的可靠性。最终,呋喹替尼的数据给了他们信心。
 迟海东博士
迟海东博士
2013年10月,礼来与和记黄埔医药正式签署协议,共同致力于新型靶向小分子抗癌药物呋喹替尼在中国大陆的研发、注册和营销。
中国本土制药企业与跨国制药企业之间的一种全新的合作模式就这样诞生了。
在礼来与和记黄埔医药的合作过程中,建立了一个完整的质量管理体系,用于指导呋喹替尼的II期和III期临床研究的成功,以保证研究在高质量的把控下完成。
2017年,呋喹替尼治疗晚期肠癌的II期临床数据发布[15]。71名晚期肠癌患者参与了临床研究,47名患者接受了呋喹替尼的治疗,24名患者接受了安慰剂的治疗。呋喹替尼组的中位无进展生存期和中位总生存时间分别为4.73个月和7.72个月,对照组分别为0.99个月和5.52个月。呋喹替尼治疗晚期肠癌效果非常显著。
为了保证II期临床数据的质量,研究团队找了第三方影像团队重新确认了研究数据。再次肯定了呋喹替尼的疗效。
这也让外界对正在进行中的III期临床研究结果充满了期待。
登顶JAMA
2017年,李进教授在ASCO年会上,口头报告了呋喹替尼的III期临床研究FRESCO的主要结果,引起国际肿瘤学界的广泛关注。会后,JAMA杂志主编主动向李进教授发出了约稿邀请。
 李进教授
李进教授
2018年6月27日,由李进教授与秦叔逵教授领衔,国内28家医院参与完成的晚期结直肠癌III期临床研究成果,成功登陆国际顶级医学期刊JAMA。
FRESCO是一个双盲、安慰剂对照、多中心的III期临床研究。在2014年12月到2016年5月之间,一共筛选了519位18至75周岁之间、二线及以上标准化疗失败的转移性结直肠癌患者。最后,一共有416位转移性肠癌患者参与了临床研究,患者平均年龄54.6岁,161名女性。

所有患者以2:1的比例,随机分成2组,试验组278名患者,接受口服呋喹替尼治疗,另外138名患者接受安慰剂治疗,两组均联合最佳支持治疗。
每个疗程28天,患者每天接受一次治疗,持续治疗21天,然后停药休息7天。后续就按照28天的周期轮回,直到患者病情进展,或者无法忍受药物的毒性等,停止用药。整个研究的数据采集一直持续到2017年1月17日,共有404名(97.1%)患者完成了试验。
结果显示:呋喹替尼组的患者中位生存期为9.3个月,与安慰剂组为6.6个月相比,延长41%,患者的死亡风险降低35%;呋喹替尼组的患者中位无进展生存期3.7个月,与安慰剂组为1.8个月相比,延长106%,患者的疾病进展风险降低74%。
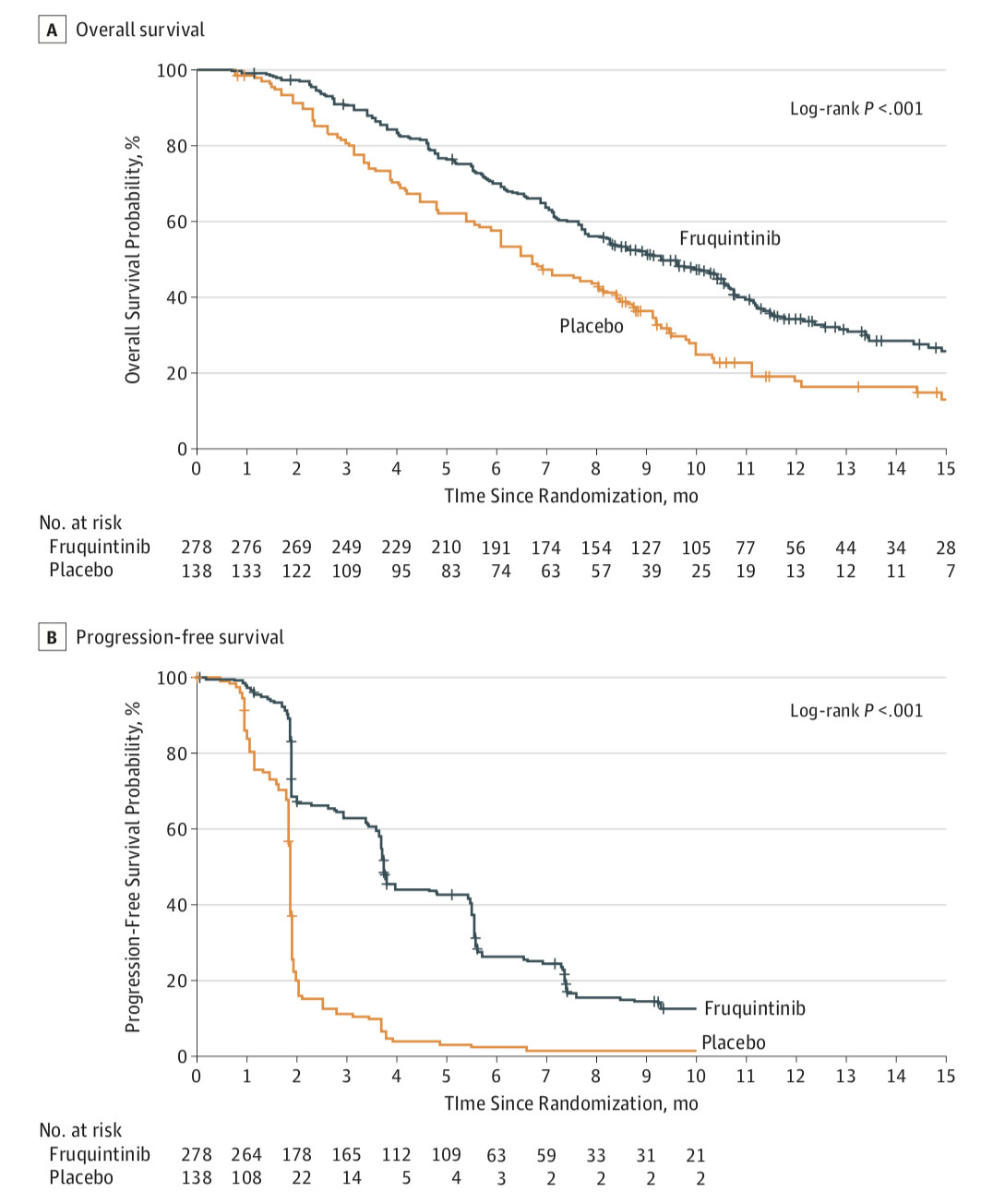
呋喹替尼还展现了良好的耐受性,最常见的3-4级不良反应为高血压,手足皮肤反应等,而3-4级肝脏毒性和安慰剂组没有差异。
除了以上生存获益外,研究人员还在亚组分析中有一个让人惊喜的发现:那些之前接受过抗EGFR或VEGF单克隆抗体药物治疗的患者,也能从呋喹替尼的治疗中获益。
“一开始接触呋喹替尼的时候,我们信心其实不是很足,因为市面上已经有索拉菲尼、舒尼替尼和瑞格非尼等药物了。”李进说,“不过,当呋喹替尼的I期临床研究结束之后,我们发现它的效能和毒副作用,与国际上的同类产品相比,有很大的优势。”
在国际范围内,脱落率是评价临床研究可靠性以及临床研究质量的一个重要指标。一般情况下,大家都认为10%是划分临床研究质量的那条线,脱落率高于10%的临床研究,所获得的临床研究结论可能存在一定的问题。
 各个亚组的数据
各个亚组的数据
“呋喹替尼的III期临床研究脱落率只有1.8%,在全球范围内都是非常领先的。”李进说,“我希望呋喹替尼的临床研究能够成为中国新药临床研究的标杆。”
在李进教授看来,呋喹替尼的III期临床研究之所以能够得到国际同行的认可,并被刊登在国际顶尖临床医学杂志上,主要是因为呋喹替尼的疗效好、耐受良好,以及临床研究质量控制得非常好。
大有可为
结肠直肠癌是全球第三大癌症,仅2015年就造成80多万人死亡[16]。自2000年以来,中国结直肠癌的年发病率和死亡率稳步上升。2015年,我国有37.6万人被确诊为结直肠癌,有19.1万结直肠癌患者死亡[17]。
氟尿嘧啶与亚叶酸钙联合伊立替康[18]或奥沙利铂[19]是治疗转移性结直肠癌的标准化疗方案之一[20,21]。“一旦一线和二线化疗失效,对于体质状况比较好的患者而言,可选的三线治疗方案非常有限。“李进教授说。
“呋喹替尼的出现,让晚期肠癌患者多了一个更好的选择,我们将会持续致力于中国的肿瘤事业,造福更多的肿瘤患者。“礼来中国抗肿瘤产品事业部副总裁钱江先生说。
当然,前期的临床研究已经显示,抑制血管生成的呋喹替尼可以治疗的不仅仅是肠癌这一种实体瘤。今年年初,由陆舜教授牵头呋喹替尼用于三线治疗“晚期非鳞状非小细胞肺癌”的II期临床研究结果发布[22],呋喹替尼也表现出非常好的效果,该项研究结果被JCO评为2018年度最佳胸部肿瘤论文,目前III期临床研究正在进行中。
此外,抗血管生成的药物在近两年再次引起人们关注的一个重要原因是:随着免疫治疗的全面发展,越来越多的临床研究表明,免疫检查点抑制剂与抗血管生成药物联合使用,会起到很好的抗癌效果。而且研究人员在肺癌[23]、肝癌[24]中都观察到这种联合治疗获益的现象。
如此看来,呋喹替尼在免疫治疗时代,可能还会发挥更大的作用。
编辑神叨叨前面还有很多未知等着科学家和医生去探索。
参考资料:[1].Jin Li, Shukui Qin, Rui-Hua Xu, Lin Shen, et al. Effect of Fruquintinib vs Placebo on Overall Survival in Patients With Previously Treated Metastatic Colorectal Cancer[J]. JAMA, 2018.[2].Lewis WH. The vascular pattern of tumours[J]. John Hopkins Hosp Bull, 1927, 41:156–173.[3].Ide A G. Vascularization of the Brown-Pearce rabbit epithelioma transplant as seen in the transparent ear chamber[J]. Am. J. Roentg., 1939, 42: 891.[4].Algire G H, Chalkley H W, Legallais F Y, et al. Vasculae reactions of normal and malignant tissues in vivo. I. vascular reactions of mice to wounds and to normal and neoplastic transplants[J]. JNCI: Journal of the National Cancer Institute, 1945, 6(1): 73-85.[5].Folkman J. Tumor Angiogenesis: Therapeutic Implications[J]. The New England Journal of Medicine, 1971, 285(21): 1182-1186.[6].Dvorak H F. Vascular permeability factor/vascular endothelial growth factor: a critical cytokine in tumor angiogenesis and a potential target for diagnosis and therapy[J]. Journal of clinical oncology, 2002, 20(21): 4368-4380.[7].Rak J, Mitsuhashi Y, Bayko L, et al. Mutant ras oncogenes upregulate VEGF/VPF expression: implications for induction and inhibition of tumor angiogenesis[J]. Cancer research, 1995, 55(20): 4575-4580.[8].Ghahremani M F, Goossens S, Nittner D, et al. p53 promotes VEGF expression and angiogenesis in the absence of an intact p21-Rb pathway[J]. Cell death and differentiation, 2013, 20(7): 888.[9].Raja R, Kale S, Thorat D, et al. Hypoxia-driven osteopontin contributes to breast tumor growth through modulation of HIF1α-mediated VEGF-dependent angiogenesis[J]. Oncogene, 2014, 33(16): 2053.[10].Chatterjee S, Heukamp L C, Siobal M, et al. Tumor VEGF: VEGFR2 autocrine feed-forward loop triggers angiogenesis in lung cancer[J]. The Journal of clinical investigation, 2013, 123(4): 1732-1740.[11].Wang X, Chen X, Fang J, et al. Overexpression of both VEGF-A and VEGF-C in gastric cancer correlates with prognosis, and silencing of both is effective to inhibit cancer growth[J]. International journal of clinical and experimental pathology, 2013, 6(4): 586.[12].Martins S F, Garcia E A, LUZ M A M, et al. Clinicopathological correlation and prognostic significance of VEGF-A, VEGF-C, VEGFR-2 and VEGFR-3 expression in colorectal cancer[J]. Cancer Genomics-Proteomics, 2013, 10(2): 55-67.[13].Sun Q, Zhou J, Zhang Z, et al. Discovery of fruquintinib, a potent and highly selective small molecule inhibitor of VEGFR 1, 2, 3 tyrosine kinases for cancer therapy[J]. Cancer biology & therapy, 2014, 15(12): 1635-1645.[14].Cao J, Zhang J, Peng W, et al. A phase I study of safety and pharmacokinetics of fruquintinib, a novel selective inhibitor of vascular endothelial growth factor receptor-1,-2, and-3 tyrosine kinases in Chinese patients with advanced solid tumors[J]. Cancer chemotherapy and pharmacology, 2016, 78(2): 259-269.[15].Xu R H, Li J, Bai Y, et al. Safety and efficacy of fruquintinib in patients with previously treated metastatic colorectal cancer: a phase Ib study and a randomized double-blind phase II study[J]. Journal of Hematology & Oncology, 2017, 10(1).[16].Fitzmaurice C, Allen C, Barber R M, et al. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study[J]. JAMA Oncology, 2017, 3(4): 524-548.[17].Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132.[18].Douillard J, Cunningham D, Roth A, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial.[J]. The Lancet, 2000, 355(9209): 1041-1047.[19].De Gramont A, Figer A, Seymour M, et al. Leucovorin and Fluorouracil With or Without Oxaliplatin as First-Line Treatment in Advanced Colorectal Cancer[J]. Journal of Clinical Oncology, 2000, 18(16): 2938-2947.[20].Grothey A, Sargent D L, Goldberg R M, et al. Survival of Patients With Advanced Colorectal Cancer Improves With the Availability of Fluorouracil-Leucovorin, Irinotecan, and Oxaliplatin in the Course of Treatment[J]. Journal of Clinical Oncology, 2004, 22(7): 1209-1214.[21].Luo H Y, Li Y, Wang W, et al. Single-agent capecitabine as maintenance therapy after induction of XELOX (or FOLFOX) in first-line treatment of metastatic colorectal cancer: randomized clinical trial of efficacy and safety[J]. Annals of Oncology, 2016, 27(6): 1074-1081.[22].Lu S, Chang J, Liu X, et al. Randomized, Double-Blind, Placebo-Controlled, Multicenter Phase II Study of Fruquintinib After Two Prior Chemotherapy Regimens in Chinese Patients With Advanced Nonsquamous Non‒Small-Cell Lung Cancer[J]. Journal of Clinical Oncology, 2018, 36(12): 1207-1217.[23].https://www.gene.com/media/press-releases/14710/2018-03-25/phase-iii-impower150-study-showed-genent[24].https://www.roche.com/media/releases/med-cor-2018-07-18.htm
 奇点:50万极客医生热爱的医疗科技媒体
奇点:50万极客医生热爱的医疗科技媒体
 本文作者 | BioTalker
本文作者 | BioTalker
“饿不死你~” |
|