|
|
本帖最后由 hyc3140 于 2023-10-6 13:12 编辑
良性胶质瘤广义上是指一组生长缓慢、增殖率低、临床过程较为缓慢的异质性胶质瘤。
《Advances in Experimental Medicine and Biology》杂志 2023年7月刊载[1405:31-71.]美国David Geffen School of Medicine at UCLA和Columbia University Medical Center的Peter B Wu , Anna C Filley , Michael L Miller , Jeffrey N Bruce撰写的《良性胶质瘤Benign Glioma》(doi: 10.1007/978-3-031-23705-8_2.)。

良性胶质瘤广义上是指一组生长缓慢、增殖率低、临床过程较为缓慢的异质性胶质瘤。这些肿瘤也可以被描述为“低级别”胶质瘤(LGG),并根据中枢神经系统(CNS)肿瘤分类被WHO分类为I级或II级病变。分子遗传学的进步提高了对神经胶质瘤发生的认识,导致确定具有重要治疗和预后意义的常见突变谱。
在胶质瘤的诊断方式上最新的WHO 2016分类系统引入了几个显著的变化,新的重点是分子特征是分化的关键因素。良性胶质瘤倾向于年轻患者,是儿童和年轻人中最常诊断的肿瘤之一。这些肿瘤在临床上可分为两个不同的亚群。第一组是局灶性的,界限明确的病变,明显与恶性转化的风险增加无关。这些WHO I级肿瘤主要在儿科患者中诊断,仅通过手术切除即可治愈。这些患者的复发率低,预后良好。弥漫性胶质瘤是WHO II级病变,具有较强的浸润性生长模式和高复发倾向。这些肿瘤主要在年轻成年患者中被诊断出来,通常表现为癫痫发作。
在许多情况下,“良性”一词是用词不当,因为这些肿瘤的自然史是恶性转化和复发为III级或IV级肿瘤。对于所有LGG,最大限度安全切除的手术是原发性和复发性肿瘤的治疗选择。手术的目标应该是大体全切除(GTR),因为完全切除肿瘤与更高的肿瘤控制率和癫痫发作自由相关。化疗和放疗(RT)虽然在大多数情况下通常不是一线治疗的组成部分,但在高风险或复发性肿瘤和某些特定病例中可作为辅助治疗。良性胶质瘤的预后差异很大;非浸润性肿瘤亚型通常预后良好,而弥漫性浸润性肿瘤虽然生长缓慢,但最终是致命的。
本章综述了良性胶质瘤的共同和独特的个体特征,包括弥漫性胶质瘤、毛细胞星形细胞瘤和毛细胞黏液样星形细胞瘤(PMA)、室管膜下巨细胞星形细胞瘤(SEGA)、多形性黄色星形细胞瘤(PXA)、室管膜下瘤(SE)、血管中心性胶质瘤(AG)和脊索样胶质瘤(CG)[diffuse glioma, pilocytic astrocytoma and pilomyxoid astrocytoma (PMA), subependymal giant cell astrocytoma (SEGA), pleomorphic xanthoastrocytoma (PXA), subependymoma (SE), angiocentric glioma (AG), and chordoid glioma (CG)]。还讨论了神经节神经胶质瘤(GG),这是一种混合的神经元-胶质肿瘤,在与其他神经节神经胶质瘤的鉴别诊断中具有重要意义。脑和脊髓室管膜瘤,包括主要的组织学亚型,在其他章节讨论。
2.1背景与流行病学
良性胶质瘤是原发性中枢神经系统肿瘤,来源于肿瘤胶质细胞,包括星形胶质细胞、少突胶质细胞和室管膜细胞系。它们可以被描述为局灶性、局限性或弥漫性浸润性病变,并根据其生长模式和总体临床过程被WHO划分为I级或II级。与高级别神经胶质瘤相比,在儿科和年轻人中更为常见低级别神经胶质瘤。它们占0-19岁儿童和青年肿瘤的45.5%,其中15岁以下儿童脑肿瘤占51.6%,15 - 39岁青少年和青年脑肿瘤占25.6% 。一个值得注意的例外是室管膜下瘤,这是一种生长缓慢的WHO I级肿瘤,在老年患者人群中,比典型的LGG患者更为常见;大多数发生在中年人中,80%的肿瘤在40岁以上的患者中被诊断出来。年龄稍大的患者也可见脊索样胶质瘤和血管中心性胶质瘤。这两种肿瘤都是极为罕见的,其研究仅限于病例报告和小病例系列,尽管对于良性胶质瘤来说是值得注意的鉴别诊断。在良性胶质瘤中,最常见的诊断为毛细胞星形细胞瘤( pilocytic astrocytoma),占15岁以下儿童脑肿瘤诊断率的17.7%,占15 - 19岁青少年脑肿瘤诊断率的8.3%。这些局灶性、界限明确的WHOI级肿瘤的诊断年龄中位数为12岁。大多数LGG是散发性病变,但偶尔也可能表现为潜在的肿瘤易感综合征,如神经纤维瘤病1型(NF1)或结节性硬化症(tuberous sclerosis,TSC)。后者与室管膜下巨细胞星形细胞瘤(SEGA) 有着密切的联系;这些病变常见于儿童期,诊断时的中位年龄为8岁。需要注意的一个重要人群是出现癫痫发作的年轻成人患者。新发癫痫是弥漫性低级别胶质瘤最常见的表现。这些WHO II级病变先前根据组织学特征被分类为少突胶质细胞瘤或星形细胞瘤(oligodendroglioma or astrocytoma);然而,最近的分类方案更多地依赖于分子标志物进行诊断。这些是相对常见的肿瘤,约占胶质瘤的15%,在35 - 44岁年龄组中发病率最高。少突胶质细胞瘤的中位诊断年龄为44岁,弥漫性星形细胞瘤的中位诊断年龄为46岁。与耐药癫痫密切相关的还有神经节胶质瘤( ganglioglioma,GG),这是一种低级别的神经胶质细胞肿瘤。GG相对常见,占所有颅内肿瘤的6.5%,与临床癫痫发作密切相关。脑肿瘤相关癫痫的一个较不常见的诊断原因是毛细胞粘液样黄色星形细胞瘤(pilomyxoid xanthoastrocytoma,PXA)。这些WHO2级肿瘤占所有脑肿瘤的不到1% ,诊断时的中位年龄为21.5岁。
2.1.1毛细胞星形细胞瘤(Pilocytic Astrocytoma,PA)
毛细胞星形细胞瘤是儿童和年轻人中最常见的原发性脑肿瘤。PA占儿童(0-14岁)原发性脑瘤的17.7%,青年(15-19岁)原发性脑瘤的8.3%,这些年龄组原发性脑瘤的总发病率为14.9%;经年龄调整后的年平均发病率为0.92 / 10万,并随着年龄的增长而下降。肿瘤发生被认为源于影响MAPK通路的改变。最常见的突变是KIAA1549-BRAF融合蛋白,尽管BRAF V600E、KRAS和NF1突变也可能出现。毛细胞星形细胞瘤最常见的部位是小脑,其次是幕上、视神经通路和脑干。后颅窝在儿童肿瘤中尤为常见,占所有PAs的* 2/3 。与幕上病变相比,小脑肿瘤的术前症状持续时间往往较短(中位3.3个月vs. 18.3个月),这一部位的大多数病变都是如此。幕上PAs几乎只见于成年患者,其发生频率与幕下肿瘤相同。视神经通路肿瘤往往与NF1的潜在诊断有关。
2.1.2毛细胞黏液样星形细胞瘤(Pilomyxoid Astrocytoma,PMA)
毛细胞黏液样星形细胞瘤(PMA)是一种相对较新的诊断,指的是一类独特的肿瘤,以前被认为是PA的一种变体,表现出一组独特的组织学、影像学和临床特征。表2.1总结了PA和PMA的经典特征。最初被描述为WHO II级肿瘤,最近的分类并不建议对所有病变进行明确WHO分级,因为已知它们同时具有WHOI级和II级肿瘤的特征。这些肿瘤的真实发病率相对未知,因为在历史上发表的报道中,它们通常被归为PA。
2.1.3室管膜下巨细胞星形细胞瘤(Subependymal Giant Cell Astrocytoma,SEGA)
室管膜下巨细胞星形细胞瘤(SEGA)是一种低级别脑室内肿瘤,通常见于结节性硬化症(TSC)患者。结节性硬化症是一种常染色体显性遗传病,由两种肿瘤抑制基因TSC1或TSC2中的突变之一引起。这些基因的蛋白产物,错构体和tuberin,分别形成抑制mTOR信号传导的二聚体。在缺乏这些抑制剂的情况下,细胞周期进程可以不受阻碍地进行,导致过度生长和肿瘤形成。TSC患者易患全身各种肿瘤。在大脑中,这表现为室管膜下结节或“结节”,SEGAs和其他皮质发育不良。患者往往在年轻时出现发育迟缓和药物难治性癫痫。
表2.1 PMA和PA的经典特征。

鉴于这种颅内病变的倾向,美国国立卫生研究院共识会议的筛查指南建议TSC儿童每1-3年进行一次脑MRI作为常规监测筛查。
2.1.4室管膜下瘤(Subependymoma ,SE)
室管膜下瘤(SE)是由室管膜细胞起源的WHO I级肿瘤。它们通常起源于脑室内膜,生长到脑室系统。它们最常见于侧脑室或第四脑室,但可能发展为脊髓髓内肿瘤或在实质内位置。SE在男性中更为常见,通常在50岁左右的中年人中被诊断出来,在儿科人群中不太常见。SE相对罕见,占颅内肿瘤的<0.1% 。Matsumura等报道,在1000例连续常规尸检中,无症状SE的发生率为0.4%,在1000例连续手术标本中为0.7%。总体而言,SE的估计发病率为0.055 / 100,000人-年,尽管考虑到许多肿瘤是无症状的,并且是在尸检或因其他原因获得的常规成像中发现的,真实发病率可能更高。有症状的患者往往会出现由肿块占位效应或阻塞性脑积水引起的功能障碍。
2.1.5血管中心性胶质瘤(Angiocentric Glioma)
血管中心性胶质瘤是一种罕见的良性肿瘤,具有独特的血管周围生长模式,与难治性癫痫有很强的相关性。它们出现在皮层和皮层下白质的表面,最常见于额叶和颞叶。这些都是极其罕见的肿瘤,关于该主题的大多数可用文献以病例报告的形式存在。大多数患者在生命的最初几十年被诊断出,主要表现为癫痫发作。
2.1.6神经节胶质瘤(gangglioma)
神经节胶质瘤(GG)是一种混合性胶质神经元肿瘤,通常与难治性癫痫有关。根据几个病例系列,GG占所有脑肿瘤的0.3%至6.5% 。GG更常见于儿童和年轻人,男性略占优势。它们通常与其他结构异常或局灶性皮质发育不良相关。这些肿瘤属于“长期与癫痫相关肿瘤(long-term epilepsy-associated tumors ,LEATs)”的范畴,往往累及颞叶,并在年轻时出现药物难治性癫痫发作(medicallyrefractory seizures)。癫痫发作是GG最常见的症状,约75%的患者出现癫痫发作,神经节胶质瘤占所有癫痫手术的14% 。
在这些病例中,病灶切除主要是从控制癫痫发作的角度出发的。在这些患者的治疗中,重要的是准确识别致痫组织,这可能与影像学上可见的病变相对应,也可能不对应。即使没有残留或复发肿瘤,患者也可能需要多次手术来充分控制癫痫发作。
2.1.7脊索样胶质瘤(Chordoid Glioma ,CG)
脊索样胶质瘤(CG)是一种罕见的低级别胶质肿瘤,起源于第三脑室前部。文献中报告的病例不到100例,已知的大部分来自个人报告和小病例系列。脊索样胶质瘤因其与脊索瘤相似的组织学表现而得名,但免疫组化结果与神经胶质瘤一致。尚不清楚CG的确切起源,但假设病变是起源于前第三脑室靠近终末板的单细胞,是特化的胶质细胞(lesions are postulated to arise from tanycytes, specialized glial cells, in the anterior third ventricle near the lamina terminalis)。基因组分析已经在几乎所有肿瘤中发现了PRKCA基因的复发性错义突变,这表明它与肿瘤发生有关(Genomic profiling has identified a recurrent missense mutation in the PRKCA gene in nearly all tumors, suggesting its implication in tumorigenesis )。
2.1.8多形性黄色星形细胞瘤(Pleomorphic Xanthoastrocytoma ,PXA)
多形性黄色星形细胞瘤(PXA)是一种相对罕见的原发性神经胶质肿瘤,通常见于以癫痫发作为表现的年轻成年患者的颞叶。其名称固有,PXA在组织学切片上表现出细胞和核的特征性多形性,使其与其他“良性”胶质瘤区别开来。
PXA是比较少见的肿瘤,占所有星形细胞瘤的<1%。它们主要在生命的第二个十年被诊断出来,诊断时的中位年龄为21.5岁,男性和女性患者的发病率相对相等。将其与其他良性胶质瘤区分开来,几乎只存在于幕上,且偏爱颞叶。根据肿瘤位置的不同,患者可能会出现多种症状,最常见的症状是癫痫发作。复发并不罕见,15-20%的病变最终发生间变,复发成为弥漫性浸润性进袭性肿瘤。
2.1.9弥漫性低级别胶质瘤
弥漫性低级别胶质瘤是最常见的原发性中枢神经系统肿瘤之一。历史上,根据组织学结构,它们被分为星形细胞瘤或少突胶质细胞瘤。星形细胞瘤类型比少突胶质细胞瘤更常见;这些实体分别占所有中枢神经系统肿瘤的1.8%和0.9%。弥漫性胶质瘤在男性和女性中的诊断率相似,成人比儿童更常发生。少突胶质细胞瘤的发病率在35 - 44岁年龄组达到高峰,而星形细胞瘤的发病率随着年龄的增长而继续增加。弥漫性低级别胶质瘤患者中特别常见的是癫痫发作,在诊断时出现在70 - 90%的患者中。在几乎一半的病例中,癫痫发作难以治疗。这在皮层病变和少突胶质细胞瘤组织学上更为常见。
2.2遗传学、免疫学、分子生物学
低级别胶质瘤发生在多种遗传改变的背景下。了解这些肿瘤的遗传基础非常重要,对现有治疗模式下低级别胶质瘤的诊断、预后和管理具有重要意义。展望未来,改进肿瘤突变特征或其独特的免疫微环境的进展有可能通过鉴定新的治疗靶点来彻底改变良性胶质瘤的治疗。最常见的遗传畸变是影响有丝分裂原激活蛋白激酶(MAPK)途径的遗传畸变,包括BRAF和NF1基因的突变。
BRAF癌基因突变可导致MEK/MAPK/ ERK/p16的组成性活性,并促进mTOR通路信号传导。mTOR通路参与细胞存活、代谢、生长和蛋白质合成;实体肿瘤中该通路的激活导致细胞增殖增加。BRAF致癌基因的激活突变存在于大多数低级别胶质瘤中,但在高级别病变中基本不存在。特别是两种突变在良性胶质瘤中的作用已被广泛表征。第一种是在7q34的串联重复,导致形成一个组成性活性激酶结构域,称为KIAA1549-BRAF融合蛋白。这在2/3的毛细胞星形细胞瘤中可见,特别是小脑肿瘤,其中90%含有这种基因变化。第二个突变是BRAF V600E突变,这是由BRAF蛋白中600位缬氨酸(V)被谷氨酸(E)取代引起的。这常见于幕上毛细胞星形细胞瘤、PXA和神经节胶质瘤。
值得注意的是,BRAF v600e突变的肿瘤与总生存率的提高相关。有几个正在进行的临床试验,评估在治疗含有这些突变的LGG患者亚组中如达拉非尼(daBRAFenib)和维莫非尼(vemurafenib)等BRAF抑制剂的疗效。支持在低级别胶质瘤发生中MAPK通路的潜在重要性的是,LGG在神经纤维瘤病1型(NF1)患者中的发生率增加。这种遗传性肿瘤易感性综合征是由NF1蛋白神经纤维蛋白突变引起的,NF1蛋白也在MAPK通路中发挥作用。结节性硬化症(TSC)是另一种与良性胶质瘤相关的肿瘤综合征,在这种情况下是SEGAs 。
TSC是由TSC1(编码结节蛋白)或TSC2(编码错构体)失活突变引起的。当发挥功能时,这些基因的蛋白产物形成抑制mTOR信号传导的二聚体。分子遗传学的知识导致了依维莫司的广泛使用,依维莫司是一种mTOR抑制剂,已被证明可以减少SEGA患者的肿瘤体积并改善癫痫控制。p53基因位于17号染色体17p13.1处,是一个核心的细胞周期调节因子,在G1/S检查点起作用,在某些条件下可以启动细胞凋亡。p53的缺失是在许多恶性肿瘤中观察到的早期遗传变化,其体细胞突变是导致癌症综合征(如LiFraumeni)的肿瘤易感性的原因。P53突变在恶性胶质瘤(63.8%)中比良性胶质瘤(41.6%)更常见,并且与低级别肿瘤向高级别肿瘤的进展有关。
PXA中最常见的基因突变是BRAF基因,特别是BRAF V600E突变,在至少2/3的肿瘤中观察到。BRAF V600E突变存在于II级和III级病变中,被认为代表了肿瘤发生的早期事件。BRAF突变的肿瘤与CD34表达相关(75%的BRAF突变对23%的BRAF-wt),并与密集网状蛋白网络的发展有关。存在的BRAF V600E突变也与位置密切相关;发现几乎所有(96%)颞叶肿瘤都表现出BRAF V600E突变,而在其他部位的PXA中,这一比例为53% 。基于BRAF突变状态,PXA可分为两个临床不同的亚组,具有不同的自然病史和对潜在治疗的反应。值得注意的是,BRAF突变的肿瘤往往具有更好的预后,与BRAF-wt病变相比,这些患者的总生存期更长。在大约一半的肿瘤中观察到的PXA的另一个常见突变是9p21.3的纯合缺失,该位点包括CDKN2A肿瘤抑制基因。同时携带BRAF和CDKN2A的低级别胶质瘤在多种肿瘤类型中具有更强的进袭性和耐药表型。
BRAF突变的频率促使对BRAF/激酶抑制剂治疗PXA的评估。Vemurafenib是一种BRAF抑制剂,已被评估为含有V600E突变的复发肿瘤的潜在挽救疗法,在小队列的一部分患者中具有活性,尽管需要未来的大规模试验来确定疗效。对于弥漫性胶质瘤,最近有兴趣的是表征异柠檬酸脱氢酶1 (IDH1)和2 (IDH2)基因的体突变在胶质瘤肿瘤发生和进展中的作用,它们编码三羧酸循环中的一种酶。IDH1的突变,通常在R132残基上,已经在超过70%的WHO II级和III级弥漫性星形细胞瘤和少突胶质细胞瘤中被发现,而在其他亚型的LGG中明显不存在。对IDH突变状态的研究也导致鉴定出由IDH-mt LGG发展而来的继发性胶质母细胞瘤(GBMs)的遗传上不同的亚群。对于所有弥漫性胶质瘤,IDH突变状态对预后和生存具有重要意义;总体而言,IDH突变(IDHmt)肿瘤往往比IDH野生型(IDH-wt)肿瘤具有更好的总体预后。随着2016年引入WHO对中枢神经系统肿瘤的分类,弥漫性低级别胶质瘤现在可以分为三个遗传上不同的组,这对治疗和预后具有重要意义。
第一组是IDH突变的肿瘤,含有1号染色体短臂(1p)和19号染色体长臂(19q)的编码,这是少突胶质细胞瘤的分子特征;进一步将其与其他LGG区分开来的是CIC、FUBP1、NOTCH1和TERT启动子频繁突变。这些肿瘤具有独特的化疗敏感性,多项研究已经证实,在其他胶质瘤亚型中未见的PCV化疗增加了显着的生存益处。在弥漫性胶质瘤中,这类肿瘤总体预后最好。第二组包含缺乏1p/19q编码的IDH-mt肿瘤,因此可以诊断为星形细胞瘤。这些肿瘤表现出p53细胞周期调节因子的功能丧失和另一种参与染色质重塑的肿瘤抑制基因ATRX的失活。值得注意的是,它们对化疗和放疗的敏感性不同,预后也不高。最后一组由同样缺乏1p/19q编码的IDH-wt肿瘤组成。弥漫性星形细胞瘤的这一亚群不表现出ATRX或TP53突变,而是与PTEN、CDKN2A或EGFR通路的畸变相关。在所有弥漫性LGG中,IDH-wt肿瘤的总体预后最差。
2.3组织病理学和形态学
胶质瘤是由星形细胞瘤、少突胶质细胞瘤和室管膜瘤等胶质细胞类型的肿瘤增生引起的;也有混合亚型,包含几个组织学上不同的成分。良性胶质瘤在免疫组化(IHC)中GFAP通常呈阳性,反映了星形细胞的起源。良性胶质瘤固有的WHO分级为I级或II级病变,缺乏恶性肿瘤的组织学特征。III级肿瘤出现间变性特征或有丝分裂指数升高,而出现明显坏死或微血管增生往往表明是IV级肿瘤。I级和II级胶质瘤的主要区别分别是界限分明和浸润性生长。大体上,局灶性胶质瘤含有不同比例的囊性和实性成分,在影像学和组织学上与周围脑组织有很好的界限。弥漫性浸润性病变显示肉眼和显微镜下浸润边缘。
2.3.1毛细胞星形细胞瘤(PA)
在大体分析中,肿瘤大体表现为软灰色肿块,常伴有囊性成分。它们界限分明,容易移位,而不是侵袭周围的薄壁组织。病变由细胞学上良性的肿瘤细胞组成,细胞明显减少,有丝分裂象非常罕见。
“毛细胞(pilocytic)”一词来源于肿瘤细胞上密集的、细长的毛发状突起。其他值得注意的组织学特征包括嗜酸性颗粒体和罗森塔尔纤维(eosinophilic granular bodies and Rosenthal fibers, ),这在低度星形细胞瘤中很常见。肿瘤细胞具有强烈的GFAP免疫反应。病变表现出主要由小胶质细胞组成的免疫微环境,与胶质母细胞瘤等恶性肿瘤相比,CD8和CD56阳性免疫细胞在血管周围和瘤内的侵袭减少。PA具有代表性的组织学特征见图2.1、2.2和2.3。
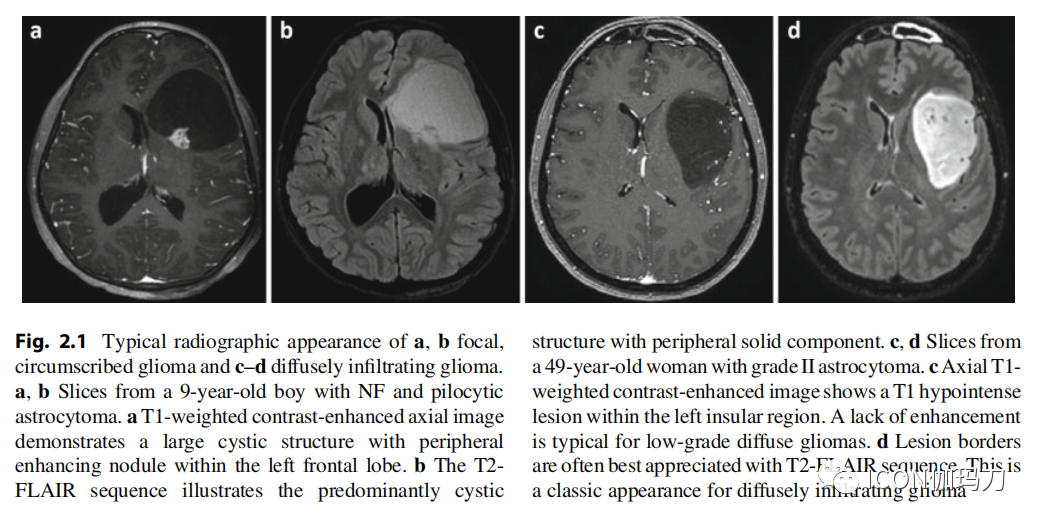
图2.1 a、b局灶性、局限性胶质瘤和c-d弥漫性浸润性胶质瘤的典型影像学表现。
a, b一个患有NF和毛细胞星形细胞瘤的9岁男孩的切片。T1加权增强轴向像示左侧额叶内有一个大囊性结构伴外周增强结节。b T2- FLAIR序列显示以囊性结构为主,周围有实性成分。c, d 49岁女性II级星形细胞瘤切片。c轴向T1加权增强图像显示左岛叶区T1低信号病变。低级别弥漫性胶质瘤的典型特征是缺乏强化。d病变边界通常最好通过T2-FLAIR序列来识别。弥漫性浸润性胶质瘤的典型表现。

图2.2毛细胞星形细胞瘤:影像学特征。
31岁女性小脑毛细胞星形细胞瘤的T1加权增强轴位图像显示,小脑右侧有一个大的、边界清晰的囊性结构。第四脑室存在肿块占位效应。周围增强结节是毛细胞星形细胞瘤的典型表现。b 7岁女孩视神经毛细胞星形细胞瘤的T1加权增强矢状像。一个对比度增强的非均匀肿块在视觉区域被注意到。36岁女性背侧外生性脑桥延髓毛细胞星形细胞瘤的T1加权增强轴位(c)和矢状位(d)图像。在脑桥延髓交界处可见边界清晰、强化的病变。

图2.3毛细胞星形细胞瘤的组织病理学特征。
a - d肿瘤细胞显示出长毛状突起,形成密集的网络,在细胞学准备(a)上最容易识别。大量罗森塔尔纤维可以看到(b),细胞聚集形成“盘子里的便士(pennies on a plate)”模式(c)。肿瘤细胞表达高水平的GFAP,证实了它们的星形细胞组织发生,这可以用免疫组织化学准备(d)来说明(a - c苏木精和伊红;d GFAP IHC;比例尺= 50 um)。
2.3.2毛黏液样星形细胞瘤(PMA)
组织学上,PMA由单型双极性肿瘤细胞松散排列在突出的黏液样背景中组成。它们的单相结构不同于PA的双相结构。偶尔可以看到肿瘤细胞聚集在血管周围,这一特征在PA中基本不存在。PMA还缺乏嗜酸性颗粒体和罗森塔尔纤维,这是PA的经典特征。与PA类似,PMA也与BRAF改变相关,但更多的是与KIAA1549-BRAF融合蛋白相关,而不是与V600E突变相关。它们还与几种发育基因的过表达有关:H19、DACT2、COL1A1、COL2A1和IGF2BP3 。PMA的代表性组织病理切片如图2.4、2.5和2.6所示。

图2.4毛细胞黏液样星形细胞瘤的组织病理学特征。
肿瘤星形胶质细胞包埋在致密的粘液样背景中。值得注意的是没有嗜酸性颗粒体和罗森塔尔纤维,这些在毛细胞星形细胞瘤中更常见。(比例尺= 50 um)。

图2.5毛细胞黏液样星形细胞瘤。
14岁女孩视神经肿瘤伴毛细胞黏液样星形细胞瘤切片。a轴位T1加权对比前图像和b轴位对比后图像显示轻度T1低信号,对比增强。c矢状位T1图像显示视神经区均匀病变。该肿瘤位于典型的PMA中线位置。d T2加权图像显示均匀的高信号病变,周围有水肿.

图2.6 SEGA。7岁女孩结节性硬化症合并室管膜下巨细胞星形细胞瘤切片。
a轴位T1加权增强图像显示右侧侧脑室管膜下空间内边界清晰、增强的肿块。本例患者双侧SEGA,常见于结节性硬化症。b这些病变在T2加权序列上呈高信号。此外,值得注意的是,其他几个T1 -低信号、T 2 -高信号、非强化病变遍及半球皮层下间隙,与结节一致,也常见于TSC患者。
2.3.3室管膜下巨细胞星形细胞瘤(SEGA)
显微镜检查显示,SEGA由多种细胞类型组成,包括成束的纤维性梭形细胞、大的神经节样细胞和肿胀的嗜酸性细胞浆的双细胞星形细胞,通常伴有明显的T细胞炎性浸润。免疫组化染色显示GFAP和S100阳性,尤其是梭形细胞成分,反映了星形细胞的起源。神经元标记物也可能存在;在神经节样细胞中可以观察到NSE、NF和突触素阳性染色。被认为是WHOI级病变,SEGAs在组织学上是良性的,且不会发生恶性转化。SEGA的组织病理学特征见图2.7、2.8和2.9。

图2.7室管膜下巨细胞星形细胞瘤的组织病理学特征。
a肿瘤细胞体积大,呈多角形,其丰富的粉红色细胞质与双细胞星形胶质细胞相似,而其细胞核特征,如囊泡染色质,细胞核突出,与神经细胞分化相似。b TTF1免疫过氧化物酶制剂显示肿瘤细胞核弥漫性染色。(比例尺= 50 um)。

图2.8室管膜下瘤。57岁男性室管膜下瘤切片。
对比增强T1加权轴位(a)、矢状位(b)和冠状位(c)切片显示第四脑室内有一个非均匀增强的肿块,第四脑室是这些肿瘤的常见位置。

图2.9神经节胶质瘤。
一个患有神经节胶质瘤的20岁女性的切片。轴位T1加权增强图像显示一个增强结节并伴有几个囊肿。T2-FLAIR序列,b显示肿瘤周围轻度水肿。
2.3.4室管膜下瘤(SE)
SE大致为白色,橡胶状,低血管病灶,与周围组织界限分明。在显微镜下,它们是由致密的原纤维胶质背景中细胞学上平淡的肿瘤细胞的低细胞簇组成的。相当一部分SE表现为混合组织学,包含不同的室管膜瘤或星形细胞瘤病理区域。组织学上病变为良性,被WHO定为I级肿瘤。有丝分裂通常不存在,核多形性、坏死或浸润等特征也不存在。在免疫组化中,GFAP通常呈阳性,synaptophysin、 vimentin、S100、olig2、 NHERF1和CD44染色多变。
2.3.5血管中心性胶质瘤
血管中心性胶质瘤是WHOI级肿瘤,预后良好。手术切除通常是可治愈的,几乎所有接受GTR治疗的患者完全无癫痫发作。血管中心性胶质瘤得名于其独特的血管周围超微结构特征,其特征是肿瘤细胞在大血管和小血管周围呈圆周、径向或纵向排列。肿瘤细胞也典型地聚集在基底下间隙,可以看到弥漫性浸润皮质组织。值得注意的是,所有肿瘤都没有其他低级别胶质瘤常见的组织学特征,包括罗森塔尔纤维和嗜酸性颗粒。肿瘤细胞是单形态的、均匀的双极细长细胞,细胞核呈细长状,GFAP、vimentin和S100蛋白呈阳性,EMA呈点状。在分子水平上,肿瘤发生与MYB-QKI重排有关,其机制包括QKI肿瘤抑制因子的破坏、MYB癌基因的激活或MYB-QKI融合癌基因的异常表达。
2.3.6.神经节细胞瘤
肿瘤在组织学上由两种主要成分定义,异形神经节细胞和肿瘤性胶质细胞(dysmorphic ganglion cells and neoplastic glial cells.)。肿瘤表现出轻微的核多形性,经常含有嗜酸性颗粒体或罗森塔尔纤维和广泛的极小钙化。在免疫组化中,它们胶质成分中的GFAP和神经元成分中的嗜色粒蛋白、突触素和NeuN呈阳性。GG与导致MAPK信号通路组成性激活的基因突变有关。特别是,GG与BRAF V600E突变有关。绝大多数病变被WHO定为I级,尽管也存在III级间变性变异。间变性神经节胶质瘤占所有神经节胶质瘤的1-5%,与肿瘤控制不良和总生存期较短有关;复发性肿瘤通常用重复切除联合辅助治疗,但最终往往是致命的。GG的典型组织病理学特征如图2.10和2.11所示。

图2.10神经节胶质瘤的组织病理学特征。
a, b这些胶质神经元肿瘤的特征是不典型胶质细胞和出现发育异常的神经节细胞(a),后者显示中心位置和突出的核仁(b)。c, d基于免疫组化制备,发育异常的神经元可能表达嗜铬粒蛋白(c),而GFAP表达突出原纤维胶质成分。e CD34的表达突出了丛型星形细胞过程以及发育不良神经元的一个子集。f这些肿瘤通常含有BRAF V600E突变,可通过使用突变特异性抗体的免疫组织化学检测。(比例尺= 50 um)。

图2.11多形性黄色星形细胞瘤。
a27岁男性多形性黄色星形细胞瘤切片。轴位T1加权增强图像显示左侧颞叶前一非均匀增强病变伴囊性成分。PXA是典型的以皮质为基础的病变。bT2-FLAIR信号也是不均匀的,既有高信号区,也有等信号区,病变不受扩散限制,这是低级别星形细胞瘤的典型特征,尽管间变性肿瘤中也可能出现DWI +区。

图2.12多形性黄色星形细胞瘤的组织病理学特征。
PXA的肿瘤星形细胞可表现出奇怪的核多形性,可被误认为是明显的恶性肿瘤;然而,这些肿瘤的有丝分裂活性通常较低(a)。一部分细胞表现为空泡状的细胞质,具有泡沫状的黄瘤样外观(a,插图)。虽然GFAP染色显示弥漫性阳性(b),与星形细胞起源一致,但肿瘤细胞也可以表达神经元标记物(未显示),提示神经细胞/混合胶质神经元分化。(比例尺= 50 um)。
2.3.7脊索样胶质瘤(CG)
CG有相当均匀的组织学表现。肿瘤由嗜酸性上皮样细胞簇包埋在液泡状粘液基质中,并有明显的淋巴浆细胞浸润。CG缺乏频繁的有丝分裂、坏死或微血管增生等特征。免疫组化:肿瘤GFAP、vimentin、EMA、CD34、细胞角蛋白弥漫性阳性,但对S100蛋白或synaptophysin(突触素)无显著反应性。CG的鉴别诊断包括鞍上病变和典型的前部第三脑室病变。GFAP染色可将CG与脊索瘤和其他非神经胶质来源的第三脑室肿块(如脑膜瘤)区分开来。CD34阳性也有助于将CG与脊索样脑膜瘤、毛细胞星形细胞瘤和室管膜瘤区分开来。脊索样胶质瘤也具有相当典型的影像学表现。它们在前部第三脑室内表现为界限清楚的卵形病变,并伴有鞍上延伸。在MRI上,CG均匀增强,T1等强度,T2加权序列略高强度。它们在CT上是高密度的,通常表现为实性,但也可有混合实性囊性组成,有时伴钙化。
2.3.8多形性黄色星形细胞瘤(PXA)
大体检查,肿瘤包含不同比例的实体和囊性成分,大约一半的病变主要是囊性的。PXA是中等细胞性肿瘤,正如其名称所示,表现出典型的细胞和核多形性。它们由各种奇异的多形性细胞组成,包括梭形肿瘤细胞,细胞核细长,大而圆的多核巨细胞,增大的黄色瘤细胞,含有突出的细胞质脂滴,淋巴细胞浸润散在灶。肿瘤细胞具有嗜酸性细胞质,具有不同数量的透明质滴和脂滴,免疫组织化学上GFAP呈不同程度的阳性。其他特征也可以看到,如嗜酸性颗粒体和罗森塔尔纤维。病变的特点是有密集的网状网络。一小部分病变,通常是复发性肿瘤或发生间变性的肿瘤,存在有丝分裂活性增加和坏死灶。III级间变性肿瘤表现出更多的恶性特征,如有丝分裂指数升高(每10个高倍视野大于5个有丝分裂)、上皮化生和坏死灶。这些病变明显保留了典型的PXA结构,这将其与其他高级星形细胞瘤(如GBM)区分开来,后者表现出微血管增生的典型假栅栏样表现。图2.12为典型PXA的组织病理学表现。
2.3.9弥漫性低级别胶质瘤
大体检查,弥漫性胶质瘤表现为柔软的灰色肿块;存在的钙化可能使其具有砂砾质地。显微镜下,病变边缘浸润,这是弥漫性低级别胶质瘤的典型特征。这些肿瘤被WHO定为II级,分化良好,缺乏高有丝分裂活性或细胞发育不全(WHOIII级)和微血管增生或坏死(WHOIV级)等组织学特征。尽管基于组织学特征的表征已被分子分类方案所取代,但组织学仍可用于弥漫性低级别胶质瘤的更广泛诊断。
少突胶质细胞瘤通常由均匀、圆形的核组成,核周有晕,在加工切片上呈“煎蛋(fried-egg)”状;这些是高度血管性肿瘤,表现出特征性的“铁丝网(chicken-wire)”血管外观。这些特征在星形细胞瘤中明显不存在,星形细胞瘤由细胞核不规则和纤维突起突出(irregular nuclei and prominent fibrillary processes )的肿瘤细胞组成。弥漫性少突胶质细胞瘤的典型组织病理学特征见图2.15,弥漫性星形细胞瘤的典型组织病理学特征见图2.16。

图2.15少突胶质细胞瘤的组织病理学特征。
a, b肿瘤少突胶质细胞弥漫性浸润皮层的高细胞脑组织(a)。高倍镜下,核相对圆形且单调,可识别典型的核周晕,形成煎蛋状。这些肿瘤细胞高度表达olig2,这是一种核转录因子,证实了它们的胶质组织发生。c, d与星形细胞相似,这些肿瘤通常含有IDH1或IDH2突变,IDH1 R132H突变特异性抗体可用于该癌蛋白的免疫组织化学检测。e然而,与弥漫性星形细胞肿瘤相比,少突胶质细胞瘤保留了ATRX的表达,这可以通过免疫组织化学来评估(比例尺= 50 um)。f这些肿瘤也可以上调PDGFR-A,这可以通过免疫组织化学染色检测到,显示强烈的膜性染色,细胞质过程相对缺乏,这在星形细胞肿瘤中更为突出。(比例尺= 50 um)。

图2.16弥漫性星形细胞瘤的组织病理学特征。
a, b肿瘤星形胶质细胞弥漫性浸润皮层的高细胞脑组织(a)。高倍镜下,肿瘤星形胶质细胞的大而成角的核轮廓可以更好地评估(b)。c这些肿瘤通常含有IDH1或IDH2突变,使用IDH1 R132H突变特异性抗体可以通过免疫组织化学检测到最常见的突变。d与少突胶质细胞瘤相比,弥漫性IDH突变星形细胞瘤通常缺乏ATRX表达,这也可以通过免疫组织化学来评估。(比例尺= 50 um)。
2.4影像学和影像组学特征
在大多数情况下,获得的第一个筛查图像是非对比计算机断层扫描(CT)扫描。然而,磁共振成像(MRI)是表征胶质瘤的最终成像方式,无论是良性的还是恶性的,都可以用来区分两者。良性胶质瘤可根据影像学表现大致分为两类。局灶性胶质瘤界限清晰,常为囊性病变,影像学边界清晰,易移位而非侵袭周围实质。典型的例子是毛细胞星形细胞瘤。第二类包括具有更强浸润性生长模式的白质病变,即弥漫性星形细胞瘤和少突胶质细胞瘤。这些病变在MRI上的影像学特征如图2.1所示。
局灶性胶质瘤大体表现为界限清晰的囊性病变,常伴有结节强化成分。CT表现为低密度病变。在MRI上,它们在T1上呈低信号,在T2上呈高信号。对比增强可能存在,特别是肿瘤的结节部分。相反,弥漫性浸润性胶质瘤边界不清。弥漫性低级别胶质瘤的大小和解剖边界通常最好通过T2/FLAIR高信号的范围来估计。MRI典型显示这些轴内病变以白质束为中心,与其他原发性皮质脑肿瘤(DNET,转移瘤)有区别。典型地,病变在MR T1加权图像上表现为低至等信号,在T2加权图像上表现为高信号,并且通常在给予钆基对比剂后不显着增强。在CT上,它们通常是低密度的,可能有明显的钙化。代谢活跃区域通常局限于Flair阳性区域,但值得注意的是,它可以延伸到这些边缘之外。虽然没有常规要求,但基于任务的血氧水平依赖(BOLD)功能MRI (fMRI)研究可以用于评估肿瘤是否接近皮层功能的重要区域,如运动和语言区域。
此外,静息状态BOLD fMRI信号与良性和恶性胶质瘤的肿瘤负荷相关。这可以通过将解剖和结构关系与潜在功能联系起来,帮助确定手术靶区和边界,从而有助于手术计划。对于T2/FLAIR高强度病变,表观弥散系数(ADC)可用于区分表现为T2高强度的良性胶质瘤和高级别胶质瘤,高级别胶质瘤通常具有较低的ADC值,表明肿瘤密度较高,但弥散受限。脑血容量(CBV)的评估是另一个与恶性肿瘤直接相关并能可靠预测肿瘤分级的参数。这也可用于监测对治疗的反应,区分肿瘤复发或恶性转化的治疗效果。高级影像也可用于良性胶质瘤的诊断。在磁共振波谱上,两组良性胶质瘤通常表现为N -乙酰天冬氨酸(NAA)和肌酸(Cr)降低,胆碱(Cho)升高。Cho与NAA和Cr比值的升高反映了细胞更新更快,并且随着肿瘤分级的增高而增加。
2.4.1毛细胞星形细胞瘤(PA)
影像学上,毛细胞星形细胞瘤的典型表现为边界明确的囊性病变,伴有小脑外侧出现的强化壁结节。囊性液体在CT上呈等密度到低密度,在T1上呈等信号至低信号,在T2上呈高信号,增强后不强化。PA的x线摄影特征示例如图2.2所示。病变表现为弥散增加(ADC亮,DWI暗)。这些特征将其与高级别肿瘤(如高级别星形细胞瘤和髓母细胞瘤)区分开来。视神经胶质瘤表现为沿视神经或视交叉生长并扩大的增强梭状病变。不太常见的是,脑干病变伴背侧外生性生长进入第四脑室;高级别脑干胶质瘤表现为弥漫性浸润、扩张性生长模式,主要影响脑桥。
2.4.2毛细胞黏液样星形细胞瘤(PMA)
影像学上,PMA是界限分明的病变,在T1加权序列上呈等信号,在对比给药时均匀增强。与PA相似,其边界清晰,没有实质浸润,很少伴有瘤周水肿。与PA相反,大多数PMA是实心的(84.6%),少数含有少量囊性成分。此外,与主要位于后颅窝的PA相比,PMA往往起源于中线结构,更常见于下丘脑/视交叉区(76.9%)。PMA的常见影像学特征如图2.5所示。
2.4.3室管膜下巨细胞星形细胞瘤(SEGA)
SEGA是大型的(>10毫米),边界明确的脑室内病变,通常发生在尾侧丘脑沟(the caudothalamic groove)。影像学表现为CT等密度,T1低至等信号,T2加权序列高信号,强烈增强。由于其位置靠近Monro孔,SEGA可能阻断脑脊液的流动,导致梗阻性脑积水的发展。SEGA的典型影像学特征如图2.6所示。
2.4.4室管膜下瘤
影像学上,SE是定义明确的分叶或结节性肿瘤,常表现为囊性变性。至少有一半的患者有脑积水的影像学证据。在CT上,病变呈等密度到低密度,没有明显的钙化。在MRI上,病变在T1上呈低信号至等信号,在T2上呈高信号。与其他脑室病变,尤其是室管膜瘤不同的是,对比剂对SE几乎没有增强作用。肿瘤周围水肿并不常见。SE的代表性x线图像如图2.8所示。
2.4.5血管中心性胶质瘤
血管中心性胶质瘤是影像学上界限清楚的病变,在CT上呈低密度。尽管一小部分含有明显的囊性成分,大多数人(90%)主要是实性。在MRI上,病变呈T2高信号,通常不随注射对比剂而增强;一些系列描述了T1加权图像上的皮质高信号边缘,尽管这并非存在于所有肿瘤中。
2.4.7多形性黄色星形细胞瘤(PXA)
影像学上,PXA是定义明确的肿块,往往位于大脑半球的表面,通常伴有反应性柔脑膜受累。病变包含实性和囊性成分。在CT上,实性部分密度变化,可能有钙化灶;囊性成分呈均匀等致密。MR图像显示T1-等信号和T2 -高信号实质成分,随着对比剂的使用,它们呈非均匀增强。囊性成分周围常可见一薄的边缘强化。可能存在相关的血管源性水肿或柔脑膜局部增强。PXA是低血管肿瘤,SPECT成像灌注减少,血管造影显示肿瘤相关血管极少。PXA的常见影像表现如图2.11所示。
最新的WHO分类系统允许将PXA分为II级或III级病变,其中大多数为WHOII级。一小部分组织学上表现为恶性的病变被WHO认定为III级间变性(aPXA) 。间变性病变可在影像学上有与其他高级星形细胞瘤相似表现。这些病变往往更大,有更明显的对比增强和肿瘤周围水肿,并可能表现为弥散受限。
2.4.8弥漫性低级别胶质瘤
典型地,少突胶质细胞瘤是基于皮质的肿瘤。相比之下,星形细胞瘤往往发生在白质深处,尽管肿瘤的生长也可能涉及表面结构。影像学上,弥漫性LGG在CT上表现为低密度至等密度,尽管在某些区域可能由于钙化而表现为高密度,这一特征在少树胶质细胞瘤中尤为常见。在MRI上,病变通常在T1上呈均匀的低信号,而在T2/FLAIR序列上呈高信号。与局灶性胶质瘤相比,这些肿瘤的边界不太明确,肿瘤边界通常由T2/FLAIR信号的范围确定。虽然典型的无增强,但40%的肿瘤表现出一定程度的增强(44%),尽管程度低于III级(84%)或IV级病变;弥漫性胶质瘤缺乏对比增强被认为是PFS的积极预测因子。灌注成像显示相对脑血容量(rCBV)较低,表明肿瘤微血管较低,肿瘤进袭性较低。与高级别胶质瘤相比,弥漫性星形细胞瘤通常不增强,由于其低细胞性,其弥散限制较少。弥漫性少突胶质细胞瘤和弥漫性星形细胞瘤的代表性影像学图像分别如图2.13和2.14所示(图2.15和2.16)。

图2.13 WHO II级弥漫性少突胶质细胞瘤。
27岁男性弥漫性少突胶质细胞瘤切片。头部CT平扫显示左侧额岛区一大块低密度病变伴局灶性钙化。T1加权对比前(b)和对比后(c)轴位片显示低信号病变。d T2-FLAIR轴向片显示高信号延伸至左岛、基底节区和颞前极。弥漫性低级别胶质瘤的典型部位和表现。e再次可见钙化灶。DWI切片显示限制最小。

图2.14 WHOⅱ级弥漫性星形细胞瘤。
49岁女性弥漫性星形细胞瘤切片。轴位T1加权对比前(a)和对比后(b)显示左岛叶区T1低信号,无增强病变。病变在T2 (c)上呈高信号,这是弥漫性低级别胶质瘤的典型表现。该病变在DWI上没有弥散限制(d)。患者肿瘤最终复发(e)。复发肿瘤在T1加权图像上呈囊性成分,增强不均质。这些特征与低级别胶质瘤向高级别胶质瘤的进展一致。在随后的切除术中,病理分析确定病变为III级。
|
|